Марганцевокислый калий
Содержание:
- Химические свойства
- Калия Перманганат: инструкция по применению (Способ и дозировка)
- Риски
- Методика спринцевания влагалища
- Цена Марганцовки. Где взять Перманганат калия?
- Свойства перманганата калия
- Физические свойства
- Химические свойства
- Окисление альдегидов и кетонов
- Перманганат калия от вредителей
- Борьба с болезнями растений
- Как возникает парапроктит
- Борьба с болезнями растений
- Цена Марганцовки. Где взять Перманганат калия?
- Марганцевые удобрение: альтернативные варианты
- Физические свойства
- Как развести марганцовку для прижигания
Химические свойства
| Окисленная форма | Восстановленная форма | Среда | E, В |
|---|---|---|---|
| MnO4− | MnO42− | OH− | +0,56 |
| MnO4− | H2MnO4 | H+ | +1,22 |
| MnO4− | MnO2 | H+ | +1,69 |
| MnO4− | MnO2 | OH− | +0,60 |
| MnO4− | Mn2+ | H+ | +1,51 |

Слева направо (водные растворы): Co(NO3)2 (красный); K2Cr2O7 (оранжевый); K2CrO4 (жёлтый); NiCl2 (бирюзовый); CuSO4 (голубой); KMnO4 (фиолетовый)
Раствор KMnO4 в воде в мерной колбе
Является сильным окислителем. В зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца(II), в нейтральной — до соединений марганца(IV), в сильно щелочной — до соединений марганца(VI). Примеры реакций приведены ниже (на примере взаимодействия с сульфитом калия):
в кислой среде:
- 2KMnO4+5K2SO3+3H2SO4⟶6K2SO4+2MnSO4+3H2O{\displaystyle {\ce {2KMnO4 + 5K2SO3 + 3H2SO4 -> 6K2SO4 + 2MnSO4 + 3H2O}}};
в нейтральной среде:
- 2KMnO4+3K2SO3+H2O⟶3K2SO4+2MnO2+2KOH{\displaystyle {\ce {2KMnO4 + 3K2SO3 + H2O -> 3K2SO4 + 2MnO2 + 2KOH}}};
в щелочной среде:
- 2KMnO4+K2SO3+2KOH⟶K2SO4+2K2MnO4+H2O{\displaystyle {\ce {2KMnO4 + K2SO3 + 2KOH -> K2SO4 + 2K2MnO4 + H2O}}}.
Однако последняя реакция (в щелочной среде) идёт по указанной схеме только при недостатке восстановителя и высокой концентрации щёлочи, которая обеспечивает замедление гидролиза манганата калия.
При соприкосновении с концентрированной серной кислотой перманганат калия взрывается, однако при аккуратном соединении с холодной кислотой реагирует с образованием неустойчивого оксида марганца(VII):
- 2KMnO4+H2SO4⟶K2SO4+Mn2O7+H2O{\displaystyle {\ce {2KMnO4 + H2SO4 -> K2SO4 + Mn2O7 + H2O}}}.
При этом в качестве промежуточного продукта может образовываться интересное соединение — оксосульфат марганца MnO3HSO4{\displaystyle {\ce {MnO3HSO4}}}. По реакции с фторидом иода(V) можно получить аналогичный оксофторид:
- KMnO4+IF5⟶KF+IOF3+MnO3F{\displaystyle {\ce {KMnO4 + IF5 -> KF + IOF3 + MnO3F}}}.
При нагревании разлагается с выделением кислорода (этим способом пользуются в лаборатории для получения чистого кислорода). Схему реакции упрощённо можно представить уравнением:
- 2KMnO4→∘tK2MnO4 +MnO2 +O2{\displaystyle {\ce {2KMnO4->K2MnO4\ +MnO2\ +O2}}}.
На самом деле реакция идёт намного сложнее, например, при не очень сильном нагревании её можно примерно описать уравнением:
- 5KMnO4→∘tK2MnO4 +K3MnO4 +3MnO2 +3O2{\displaystyle {\ce {5KMnO4->K2MnO4\ +K3MnO4\ +3MnO2\ +3O2}}}.
Реагирует с солями двухвалентного марганца, например:
- 2KMnO4+3MnSO4+2H2O⟶5MnO2+K2SO4+2H2SO4{\displaystyle {\ce {2KMnO4 + 3MnSO4 + 2H2O -> 5MnO2 + K2SO4 + 2H2SO4}}}.
Эта реакция в принципе обратна дисмутации (диспропорционирование) K2MnO4{\displaystyle {\ce {K2MnO4}}} на MnO2{\displaystyle {\ce {MnO2}}} и KMnO4{\displaystyle {\ce {KMnO4}}}.
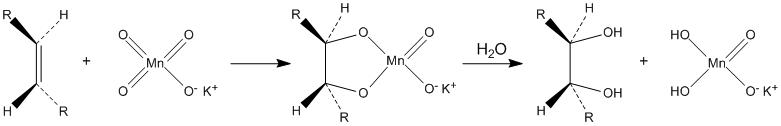
Окисляет органические вещества. В частности, разбавленные растворы перманганата калия в щелочной и нейтральной среде окисляют алкены до диолов (реакция Вагнера):
Водные растворы перманганата калия термодинамически нестабильны, но кинетически довольно устойчивы. Их сохранность резко повышается при хранении в темноте.
При смеси с пероксидом водорода протекает следующая реакция:
- 2KMnO4+3H2O2⟶2MnO2+3O2↑+2H2O+2KOH{\displaystyle {\ce {2KMnO4 +3H2O2 -> 2MnO2 + 3O2 ^ + 2H2O + 2KOH}}}.
Перманганат калия реагирует с концентрированной соляной, бромоводородной или иодоводородной кислотой. В результате выделяются свободные галогены:
- 2KMnO4+16HCl⟶2KCl+2MnCl2+5Cl2↑+8H2O{\displaystyle {\ce {2KMnO4 + 16HCl -> 2KCl + 2MnCl2 + 5Cl2 ^ + 8H2O}}}
Во время химической реакции хлорид-анион Cl−{\displaystyle {\ce {Cl^{-}}}} окисляется до элементарного хлора, а ион Mn7+{\displaystyle {\ce {Mn^{7+}}}} в перманганат-анионе восстанавливается до катиона Mn2+{\displaystyle {\ce {Mn^{2+}}}}:
- 2Cl−⟶Cl2↑{\displaystyle {\ce {2Cl^{-}-> Cl2 ^}}}
- Mn7+⟶Mn2+{\displaystyle {\ce {Mn^{7+}-> Mn^{2+}}}}
Калия Перманганат: инструкция по применению (Способ и дозировка)
Согласно инструкции по применению, средство применяется наружно, в виде водных растворов различной концентрации:
- 0,02-1%-ный — для промывания желудка при отравлении, спринцеваний и подмывания;
- 0,01-1%-ный — для полоскания горла и ротовой полости;
- 0,1-05%-ный раствор — для обработки ран;
- 2-5%-ный — для смазывания ожоговых и язвенных поверхностей.
Применение концентрированных растворов Марганцовки
Пятипроцентный раствор марганцовокислого калия считается особенно концентрированным, поэтому он не может ни при каких обстоятельствах использоваться для внутреннего потребления и обработки слизистых: средство применяется только в крайних случаях и только наружно.
Некоторые специалисты рекомендуют использовать его для лечения грибковой инфекции кожи и онихомикозов, однако большинство микологов предпочитают назначать специальные противогрибковые препараты, поскольку они, по их мнению, более безопасны и эффективны.
Бытует также мнение что 5%-ный раствор эффективен при укусах ядовитых насекомых (например, тарантулов или скорпионов) и ядовитых змей. В данном случае его используют для промывания пораженного места, однако подобная мера может расцениваться только как первая помощь пострадавшему, и не отменяет необходимости обращения к врачу и немедленной (если это необходимо) госпитализации.
В народной медицине примочки с концентрированным холодным (!) раствором марганцовки иногда используются для лечения термических ожогов. Считается также, что регулярная обработка опасных с точки зрения появления пролежней участков тела крепким раствором марганцовокислого калия, помогает предупредить дистрофическое или язвенно-некротическое изменение тканей.
Безопасность и эффективность такого лечения, однако, следует в обязательном порядке обсуждать с лечащим врачом.
Пятипроцентный раствор используется и для лечения генерализованных поражений кожи, например, пиодермии.
Ванна от прыщей с марганцовокислым калием способствует ускорению подсыхания элементов сыпи и отпадению корочек. Процедуру повторяют ежедневно до исчезновения проявлений заболевания. Продолжительность воздействия — не более 15 минут. После ванной рекомендуется ополоснуть кожу прохладной водой.
Концентрированный раствор можно использовать от прыщей на спине, а также для прижигания мозолей и бородавок. Средство в указанных случаях наносят точечно.
Как развести Марганцовку при ветрянке?
При ветрянке перманганат калия разводят таким образом, чтобы получился не слишком концентрированный раствор. Это значит, что жидкость должна быть светло-розового цвета.
Правила разведения следующие: вначале несколько крупинок марганцовки растворяют примерно в 500 мл теплой воды, а затем полученный раствор переливают в другую емкость и доводят объем воды до нужного.
Сменным в растворе ватным тампоном протирают места высыпаний. Когда высыпания сойдут, для ускорения процесса подсыхания корочек можно принимать ванны с неконцентрированным раствором марганцовокислого калия.
Как сделать 5% раствор Марганцовки?
Для приготовления 5%-ного раствора 5 граммов препарата растворяют в 100 мл воды. Чтобы не ошибиться с дозировкой, необходимо пользоваться кухонными весами.
Если весов нет, в расчетах нужного количества перманганата калия отталкиваются от того, что в 1 ч. ложке его вмещается 6 граммов. Таким образом, для получения 5%-ного раствора, следует добавить это количество марганцовки к 120 мл воды.
Если в аптеке был куплен 3-х граммовый флакон с марганцовкой, для получения раствора нужной концентрации перманганат калия следует соединить с 60 мл воды.
Когда все кристаллы растворятся в воде, готовый раствор процеживают сквозь сложенную в несколько слоев марлю.
Как разводить для купания новорожденного Марганцовку?
Поскольку кожа младенцев очень нежная и чувствительная, для купания должен использоваться светло-розовый, не концентрированный раствор для купания.
Рекомендации относительно того, как сделать слабый раствор марганцовки следующие: в прозрачную стеклянную посуду наливают теплой воды и добавляют небольшое (на кончике ножа) количество перманганата калия.
Убедившись, что все кристаллики растворились, раствор переливают в другую емкость и доливают воду до нужного объема.
Риски
Наиболее значительный риск, связанный с марганцем для людей, это когда они вдыхают его. Плавка и сварка являются двумя видами деятельности с высоким риском случайного вдыхания марганца. Вдыхаемый марганец опасен тем, что организм транспортирует минералы непосредственно в мозг без предварительной обработки. С течением времени этот марганец может привести к серьезному состоянию, называемому манганизм, который похож на болезнь Паркинсона. Симптомы манганизма включают:
- трудности при ходьбе;
- мышечные спазмы на лице;
- тремор;
- раздражительность;
- агрессивность;
- галлюцинации;
- снижение функции легких.
Человек редко может испытывать подобные симптомы.
Научная статья по теме: Марганец может привести к смертельной сердечной инфекции.
Методика спринцевания влагалища
У спринцевания влагалища есть свой алгоритм выполнения процедуры. Заключается он в следующем:
Женщина занимает положение лежа на гинекологическом кресле или кушетке, которые застелены клеенкой и чистой пеленкой или простыней. Снизу под таз подставляется специальное судно, в которое будет стекать раствор. Если делается горячее спринцевание, то судно не нужно, так как при использовании наконечника Морозова или промывателя Пинкуса жидкость по трубке сливается прямо в ведро
После того, как пациентка заняла надлежащую позицию, акушерка осторожно вводит наконечник кружки или другого инструмента во влагалище, снимает зажим с резиновой трубки и жидкость начинает поступать внутрь. Кружку при этом удерживают на высоте около метра над уровнем живота женщины.
С особой осторожностью необходимо проводить спринцевание влагалища девушкам, не имевшим половых контактов, так как имеется шанс повредить девственную плеву. При проведении процедуры таким пациенткам пластиковый наконечник заменяется на резиновый катетер, а раствор вводится под небольшим напором.. Стоит отметить некоторые моменты, при которых спринцевание влагалища не делается
К ним относятся: беременность, менструация, первые несколько дней после родов или аборта. К тому же не надо забывать, что частые промывания могут нарушить естественную микрофлору влагалища, а это уже грозит быстрым размножением патогенных микроорганизмов и, как следствие различного рода осложнениями. Поэтому любое спринцевание, даже если оно лечебное, не должно проводиться без консультации и назначения гинеколога.
Стоит отметить некоторые моменты, при которых спринцевание влагалища не делается. К ним относятся: беременность, менструация, первые несколько дней после родов или аборта. К тому же не надо забывать, что частые промывания могут нарушить естественную микрофлору влагалища, а это уже грозит быстрым размножением патогенных микроорганизмов и, как следствие различного рода осложнениями. Поэтому любое спринцевание, даже если оно лечебное, не должно проводиться без консультации и назначения гинеколога.
Также хотелось бы развеять некоторые мифы по поводу спринцевания влагалища как способа предотвратить наступление беременности или защитить от инфекций, передающихся половым путем. Гинекологами всего мира научно доказано, что ни один раствор не снижает риск нежелательного зачатия, даже если спринцевание было проведено сразу после полового акта. Что касается инфекционных заболеваний — также не имеется никаких достоверных фактов, что промывание влагалища антисептическими растворами помогут избежать заражения.
Цена Марганцовки. Где взять Перманганат калия?
Приобрести Перманганат калия непросто. В интернете много как сообщений о том, что марганцовка запрещена и найти ее очень проблематично.
На вопрос, почему запретили продажу этого средства, некоторые фармацевты отвечают, что соответствующими приказами марганцовку приравняли к взрывчатым веществам, и продавать ее без лицензии нельзя.
Другие же говорят, что марганцовокислый калий отнесен к наркотическим веществам и, опять-таки, его продажа без соответствующей лицензии невозможна.
В советах относительно того, где купить марганцовку в аптеке Москвы, обычно указывают специализированные аптеки при родильных отделениях и детских поликлиниках, а также ветеринарные аптеки.
Перманганат калия купить в Москве можно также в хозяйственных магазинах и магазинах, которые реализуют товары для садоводства.
Аналогичные рекомендации дают в ответ на вопрос, где можно купить марганцовокислый калий в СПб или Киеве.
Свойства перманганата калия
Марганцовка – мощнейший антисептик, способный подавить жизнедеятельность большей части патогенных микроорганизмов. Приобрести этот препарат можно как в аптеке, так и в садовом павильоне. Стоимость перманганата калия приятно удивляет, тем более, что доза препарата для приготовления действенного раствора исчисляется в миллиграммах, и одного флакона марганцовки хватает надолго. Отмерить мизерное количество кристаллов в полевых условиях проблематично, поэтому готовят растворы преимущественно на глаз. Различают крепость состава по цвету: бледно-розовый (слабый), ярко-розовый (умеренный) и темно-розовый (крепкий).
Физические свойства
Внешний вид: тёмно-фиолетовые кристаллы с металлическим блеском. Показатель преломления составляет 1,59 (при 20 °C).
Растворяется в воде (см. таблицу), жидком аммиаке, ацетоне (2:100), метаноле, пиридине.
| Температура, °C | 10 | 20 | 25 | 30 | 40 | 50 | 65 |
|---|---|---|---|---|---|---|---|
| Растворимость, г/100 г воды | 4,22 | 6,36 | 7,63 | 9 | 12,5 | 16,8 | 25 |
Термодинамические свойства
| Стандартная энтальпия образования ΔH | −813,4 кДж/моль (т) (при 298 К) |
|---|---|
| Стандартная энергия Гиббса образования G | −713,8 кДж/моль (т) (при 298 К) |
| Стандартная энтропия S | 171,71 Дж/(моль·K) (т) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 119,2 Дж/(моль·K) (т) (при 298 К) |
Химические свойства
| Окисленная форма | Восстановленная форма | Среда | E, В |
|---|---|---|---|
| MnO4− | MnO42− | OH− | +0,56 |
| MnO4− | H2MnO4 | H+ | +1,22 |
| MnO4− | MnO2 | H+ | +1,69 |
| MnO4− | MnO2 | OH− | +0,60 |
| MnO4− | Mn2+ | H+ | +1,51 |

Слева направо (водные растворы): Co(NO3)2 (красный); K2Cr2O7 (оранжевый); K2CrO4 (жёлтый); NiCl2 (бирюзовый); CuSO4 (голубой); KMnO4 (фиолетовый)
Раствор KMnO4 в воде в мерной колбе
Является сильным окислителем. В зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца(II), в нейтральной — до соединений марганца(IV), в сильно щелочной — до соединений марганца(VI). Примеры реакций приведены ниже (на примере взаимодействия с сульфитом калия):
в кислой среде:
- 2KMnO4+5K2SO3+3H2SO4⟶6K2SO4+2MnSO4+3H2O{\displaystyle {\ce {2KMnO4 + 5K2SO3 + 3H2SO4 -> 6K2SO4 + 2MnSO4 + 3H2O}}};
в нейтральной среде:
- 2KMnO4+3K2SO3+H2O⟶3K2SO4+2MnO2+2KOH{\displaystyle {\ce {2KMnO4 + 3K2SO3 + H2O -> 3K2SO4 + 2MnO2 + 2KOH}}};
в щелочной среде:
- 2KMnO4+K2SO3+2KOH⟶K2SO4+2K2MnO4+H2O{\displaystyle {\ce {2KMnO4 + K2SO3 + 2KOH -> K2SO4 + 2K2MnO4 + H2O}}}.
Однако последняя реакция (в щелочной среде) идёт по указанной схеме только при недостатке восстановителя и высокой концентрации щёлочи, которая обеспечивает замедление гидролиза манганата калия.
При соприкосновении с концентрированной серной кислотой перманганат калия взрывается, однако при аккуратном соединении с холодной кислотой реагирует с образованием неустойчивого оксида марганца(VII):
- 2KMnO4+H2SO4⟶K2SO4+Mn2O7+H2O{\displaystyle {\ce {2KMnO4 + H2SO4 -> K2SO4 + Mn2O7 + H2O}}}.
При этом в качестве промежуточного продукта может образовываться интересное соединение — оксосульфат марганца MnO3HSO4{\displaystyle {\ce {MnO3HSO4}}}. По реакции с фторидом иода(V) можно получить аналогичный оксофторид:
- KMnO4+IF5⟶KF+IOF3+MnO3F{\displaystyle {\ce {KMnO4 + IF5 -> KF + IOF3 + MnO3F}}}.
При нагревании разлагается с выделением кислорода (этим способом пользуются в лаборатории для получения чистого кислорода). Схему реакции упрощённо можно представить уравнением:
- 2KMnO4→∘tK2MnO4 +MnO2 +O2{\displaystyle {\ce {2KMnO4->K2MnO4\ +MnO2\ +O2}}}.
На самом деле реакция идёт намного сложнее, например, при не очень сильном нагревании её можно примерно описать уравнением:
- 5KMnO4→∘tK2MnO4 +K3MnO4 +3MnO2 +3O2{\displaystyle {\ce {5KMnO4->K2MnO4\ +K3MnO4\ +3MnO2\ +3O2}}}.
Реагирует с солями двухвалентного марганца, например:
- 2KMnO4+3MnSO4+2H2O⟶5MnO2+K2SO4+2H2SO4{\displaystyle {\ce {2KMnO4 + 3MnSO4 + 2H2O -> 5MnO2 + K2SO4 + 2H2SO4}}}.
Эта реакция в принципе обратна дисмутации (диспропорционирование) K2MnO4{\displaystyle {\ce {K2MnO4}}} на MnO2{\displaystyle {\ce {MnO2}}} и KMnO4{\displaystyle {\ce {KMnO4}}}.
Окисляет органические вещества. В частности, разбавленные растворы перманганата калия в щелочной и нейтральной среде окисляют алкены до диолов (реакция Вагнера):

Водные растворы перманганата калия термодинамически нестабильны, но кинетически довольно устойчивы. Их сохранность резко повышается при хранении в темноте.
При смеси с пероксидом водорода протекает следующая реакция:
- 2KMnO4+3H2O2⟶2MnO2+3O2↑+2H2O+2KOH{\displaystyle {\ce {2KMnO4 +3H2O2 -> 2MnO2 + 3O2 ^ + 2H2O + 2KOH}}}.
Перманганат калия реагирует с концентрированной соляной, бромоводородной или иодоводородной кислотой. В результате выделяются свободные галогены:
- 2KMnO4+16HCl⟶2KCl+2MnCl2+5Cl2↑+8H2O{\displaystyle {\ce {2KMnO4 + 16HCl -> 2KCl + 2MnCl2 + 5Cl2 ^ + 8H2O}}}
Во время химической реакции хлорид-анион Cl−{\displaystyle {\ce {Cl^{-}}}} окисляется до элементарного хлора, а ион Mn7+{\displaystyle {\ce {Mn^{7+}}}} в перманганат-анионе восстанавливается до катиона Mn2+{\displaystyle {\ce {Mn^{2+}}}}:
- 2Cl−⟶Cl2↑{\displaystyle {\ce {2Cl^{-}-> Cl2 ^}}}
- Mn7+⟶Mn2+{\displaystyle {\ce {Mn^{7+}-> Mn^{2+}}}}
Окисление альдегидов и кетонов
Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO4, K2Cr2O7, [Ag(NH3)2]OH, Cu(OH)2. Все реакции идут при нагревании:
3CH3CHO + 2KMnO4 → CH3COOH + 2CH3COOK + 2MnO2 + H2O
3CH3CHO + K2Cr2O7 + 4H2SO4 → 3CH3COOH + Cr2(SO4)3 + 7H2O
CH3CHO + 2KMnO4 + 3KOH → CH3COOK + 2K2MnO4 + 2H2O
5CH3CHO + 2KMnO4 + 3H2SO4 → 5CH3COOH + 2MnSO4 + K2SO4 + 3H2O
CH3CHO + Br2 + 3NaOH → CH3COONa + 2NaBr + 2H2O

реакция «серебряного зеркала»
C аммиачным раствором оксида серебра альдегиды окисляются до карбоновых кислот которые в аммиачном растворе дают соли аммония (реакция «серебрянного зеркала»):
CH3CH=O + 2[Ag(NH3)2]OH → CH3COONH4 + 2Ag + H2O + 3NH3
CH3–CH=O + 2Cu(OH)2 → CH3COOH + Cu2O + 2H2O
Муравьиный альдегид (формальдегид) окисляется, как правило, до углекислого газа:
5HCOH + 4KMnO4(изб) + 6H2SO4 → 4MnSO4 + 2K2SO4 + 5CO2 + 11H2O
3СН2О + 2K2Cr2O7 + 8H2SO4 → 3CO2 +2K2SO4 + 2Cr2(SO4)3 + 11H2O
HCHO + 4[Ag(NH3)2]OH → (NH4)2CO3 + 4Ag↓ + 2H2O + 6NH3
HCOH + 4Cu(OH)2 → CO2 + 2Cu2O↓+ 5H2O
Кетоны окисляются в жестких условия сильными окислителями с разрывом связей С-С и дают смеси кислот:
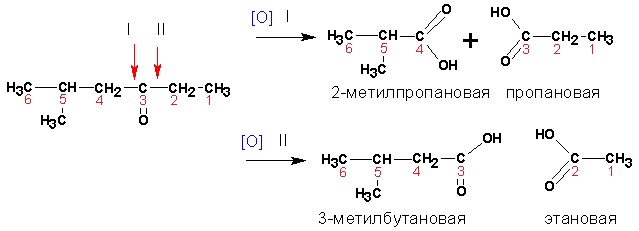
Карбоновые кислоты. Среди кислот сильными восстановительными свойствами обладают муравьиная и щавелевая, которые окисляются до углекислого газа.
НСООН + HgCl2 =CO2 + Hg + 2HCl
HCOOH+ Cl2 = CO2 +2HCl
HOOC-COOH+ Cl2 =2CO2 +2HCl
Муравьиная кислота, кроме кислотных свойств, проявляет также некоторые свойства альдегидов, в частности, восстановительные. При этом она окисляется до углекислого газа. Например:
При нагревании с сильными водоотнимающими средствами (H2SO4 (конц.) или P4O10) разлагается:
Перманганат калия от вредителей
Хороший результат также дает применение марганца для защиты растений от вредителей:
- проволочника, повреждающего корнеплоды;
- мушек разных видов;
- слюнявки-пенницы, угрожающей землянике.
В первых двух случаях можно избавиться от вредителей, если перед посадкой пролить землю насыщенным раствором марганцовки (5 г вещества на 10 л воды), а также замочить семена и клубни. Для уничтожения вредителя земляники достаточно облить поврежденные кусты горячим (около 65º) ярко-розовой консистенцией марганцовокислого калия. Такие горячие омывания, проведенные вечером, полезны для кустов на любых этапах их развития. Только для молоденьких кустиков температура должна быть не выше 45º.
Можно проводить обеззараживание садового снаряжения с помощью такого недорогого средства
Борьба с болезнями растений
Фитофтороз или фитофтора
Фитофторе основном подвержены пасленовые культуры. В профилактических целях рекомендуется раз в две недели обильно опрыскивать кусты томатов, перцев, баклажан и картофеля специальным лечебным раствором: на ведро воды берут 2-3 г кристалликов марганцовки и стакан выдавленного чеснока. Смесь отстаивают 3-4 часа, процеживают и добавляют в нее 2 столовые ложки жидкого мыльного средства, чтобы раствор прилипал к растениям.
Мучнистая роса
К сожалению, мучнистая роса известна многим садоводам и огородникам. Она поражает клубнику, смородину, малину, другие ягодные кусты и плодовые деревья, огурцы и прочие бахчевые культуры, а также цветы. При первых симптомах заболевания необходимо развести ярко-розовый раствор марганца и обильно опрыскать все пораженные части растений. Лечение нужно проводить 3-4 раза через 5 дней.
Серая гниль
Такая грибковая болезнь растений как серая гниль наиболее часто поражает землянику, виноград, малину, капусту, лук. Для защиты культур от этого грибка тоже можно применять окропление раствором марганцовки. Весной следует применять бледно-розовую смесь (2 г на ведро воды), а перед завязыванием плодов рекомендуется использовать более насыщенную консистенцию (1 г вещества на литр воды).
Для профилактики растений эффективно применять раствор калиевой соли
Черная ножка
Раствор калиевой соли марганцовой кислоты может активно бороться и с черной ножкой – болезнью, часто поражающей рассаду овощных культур, а иногда и взрослые кусты томатов, капусту, цветы. Для профилактики рассаду рекомендуют полить под корень слабо-розовой смесью перманганата калия. При появлении заболевания поврежденное растение необходимо убрать вместе со слоем земли, подсыпать золу или песок и обильно пролить почву насыщенным раствором марганцовки.
Как возникает парапроктит
Как возникает болезнь? В нижнем отделе прямой кишки (в заднем проходе) имеются слизистые желёзки, которые своим секретом смачивают поверхность кишки, облегчая выход кала, если он пересушен. При запорах слизистая повреждается, образуются ссадины, трещины, в которые и попадает инфекция. Замечу, в одном грамме кала содержатся миллионы единиц разной флоры. Вот и начинаются всякие неприятности.
То же происходит, когда стул жидкий — кислая масса вызывает разрыхление этой зоны, также с возможным инфицированием. Да и при нормальном стуле не исключено подобное — вроде бы и жалоб особых нет, но организм ослаблен, а тут человек взял да и съел острый соус, горчицу, хрен. Слизистая мгновенно раздражается, возникают ее ожоги. Далее болезнь развивается по известному сценарию: инфекция вместе с воспалительными проявлениями распространяется на параректальную клетчатку — соединительную ткань, окружающую прямую кишку.
Парапроктит начинается с зуда, незначительного дискомфорта в области анального отверстия, потом болезнь набирает обороты, образуются гнойные затеки, которые могут переходить в различные свищевые формы, прорываться наружу, на поверхность кожи. Если прорыва нет, гнойная масса выходит вместе со слизью, другими неприятными гнилостными выделениями через задний проход. Острый парапроктит развивается внезапно: повышается температура, появляются резкие боли в области прямой кишки, не дающие покоя, и после бессонной ночи человек обращается к врачу. Правда, есть стертые формы болезни — пациент как бы и не жалуется на сильную боль, но воспалительный инфильтрат прощупывается. В таком случае, чтобы поставить точный диагноз, надо сделать УЗИ, компьютерную томографию или провести магнитно-ядерно-резонансное исследование. Одного анализа крови недостаточно, поскольку картина может быть нормальной, хотя порой и наблюдается лейкоцитоз.
При хронической форме парапроктита свищи долго не заживают. И тогда у пациента берут мазки для выяснения причины этого затяжного процесса, поскольку свищевую форму хронического парапроктита могут давать туберкулез, сифилис, рак, болезнь Крона, другие заболевания. Но чаще сказывается банальная свищевая форма — с выделением кишечной палочки и гноя.
Встречаются также внутренние неполные свищи, когда инфекция попадает в анальную трещину. Воспаление перифокально0^ клетчатки приводит к абсцедй«рованию. Гной не может выйти наружу из-за очень плотной тол -стой кожи. В этом случае необходимо вскрыть, дренировать гнойник. Если гной выходит через внутреннее отверстие свища, то выделения идут из заднего прохода. Свищи располагаются у всех больных по-разному. У одних — в 2-3 см от анального отверстия — их можно прощупать пальцами, разглядеть в зеркало, у других — в верхних отделах прямой кишки.
Борьба с болезнями растений
Фитофтороз или фитофтора
Фитофторе основном подвержены пасленовые культуры. В профилактических целях рекомендуется раз в две недели обильно опрыскивать кусты томатов, перцев, баклажан и картофеля специальным лечебным раствором: на ведро воды берут 2-3 г кристалликов марганцовки и стакан выдавленного чеснока. Смесь отстаивают 3-4 часа, процеживают и добавляют в нее 2 столовые ложки жидкого мыльного средства, чтобы раствор прилипал к растениям.
Мучнистая роса
К сожалению, мучнистая роса известна многим садоводам и огородникам. Она поражает клубнику, смородину, малину, другие ягодные кусты и плодовые деревья, огурцы и прочие бахчевые культуры, а также цветы. При первых симптомах заболевания необходимо развести ярко-розовый раствор марганца и обильно опрыскать все пораженные части растений. Лечение нужно проводить 3-4 раза через 5 дней.
Серая гниль
Такая грибковая болезнь растений как серая гниль наиболее часто поражает землянику, виноград, малину, капусту, лук. Для защиты культур от этого грибка тоже можно применять окропление раствором марганцовки. Весной следует применять бледно-розовую смесь (2 г на ведро воды), а перед завязыванием плодов рекомендуется использовать более насыщенную консистенцию (1 г вещества на литр воды).

Для профилактики растений эффективно применять раствор калиевой соли
Черная ножка
Раствор калиевой соли марганцовой кислоты может активно бороться и с черной ножкой – болезнью, часто поражающей рассаду овощных культур, а иногда и взрослые кусты томатов, капусту, цветы. Для профилактики рассаду рекомендуют полить под корень слабо-розовой смесью перманганата калия. При появлении заболевания поврежденное растение необходимо убрать вместе со слоем земли, подсыпать золу или песок и обильно пролить почву насыщенным раствором марганцовки.
Цена Марганцовки. Где взять Перманганат калия?
Приобрести Перманганат калия непросто. В интернете много как сообщений о том, что марганцовка запрещена и найти ее очень проблематично.
На вопрос, почему запретили продажу этого средства, некоторые фармацевты отвечают, что соответствующими приказами марганцовку приравняли к взрывчатым веществам, и продавать ее без лицензии нельзя.
Другие же говорят, что марганцовокислый калий отнесен к наркотическим веществам и, опять-таки, его продажа без соответствующей лицензии невозможна.
В советах относительно того, где купить марганцовку в аптеке Москвы, обычно указывают специализированные аптеки при родильных отделениях и детских поликлиниках, а также ветеринарные аптеки.
Перманганат калия купить в Москве можно также в хозяйственных магазинах и магазинах, которые реализуют товары для садоводства.
Аналогичные рекомендации дают в ответ на вопрос, где можно купить марганцовокислый калий в СПб или Киеве.
Сколько стоит в аптеке Марганцовка? Цена средства варьируется в пределах от 11 до 165 руб. (в зависимости от объема упаковки и формы выпуска).
Образование: Окончила Ровенский государственный базовый медицинский колледж по специальности «Фармация». Окончила Винницкий государственный медицинский университет им. М.И.Пирогова и интернатуру на его базе.
Опыт работы: С 2003 по 2013 г. – работала на должностях провизора и заведующего аптечным киоском. Награждена грамотами и знаками отличия за многолетний и добросовестный труд. Статьи на медицинскую тематику публиковались в местных изданиях (газеты) и на различных Интернет-порталах.
Марганцевые удобрение: альтернативные варианты
Если на самом деле растения на участке демонстрируют признаки дефицита марганца, вместо марганцовки лучше взять хорошее современное микроудобрение. Например, одно из следующих:
| Название | Общая характеристика | Средняя стоимость |
| «Микровит Стандарт» | Жидкое удобрение, содержащее 20 г/л марганца в хелатной форме. Очень легко усваивается растениями. Не фитотоксично. Обогащено другими важными для растений элементами – бором, серой, калием, фосфором, цинком, медью и т.д. | 250 рублей за 250 мл |
| «Микровит К» | Хелатное жидкое комплексное микроудобрение, содержащее 31 г/л хелатированного марганца. | 670 рублей за 1 л |
| Хелат марганца | Водорастворимый порошок. Содержит около 13% марганца в хелатной форме, максимально биодоступной как через корни, так и через листья. | 25 рублей за 10 г |
| «Силиплант Универсальный» | Жидкое хелатное удобрение, содержащее биоактивный кремний. Марганца в нём 150 мг/л. Является не только удобрением, но и стимулятором роста. | 280 рублей за 100 мл |
Также можно использовать для подкормки старый проверенный сульфат марганца. Он усваивается хуже, чем хелаты, и подходит не всех типов почвы, но стоит недорого и может применяться для внекорневой подкормки.

Физические свойства
Внешний вид: тёмно-фиолетовые кристаллы с металлическим блеском. Показатель преломления составляет 1,59 (при 20 °C).
Растворяется в воде (см. таблицу), жидком аммиаке, ацетоне (2:100), метаноле, пиридине.
| Температура, °C | 10 | 20 | 25 | 30 | 40 | 50 | 65 |
|---|---|---|---|---|---|---|---|
| Растворимость, г/100 г воды | 4,22 | 6,36 | 7,63 | 9 | 12,5 | 16,8 | 25 |
Термодинамические свойства
| Стандартная энтальпия образования ΔH | −813,4 кДж/моль (т) (при 298 К) |
|---|---|
| Стандартная энергия Гиббса образования G | −713,8 кДж/моль (т) (при 298 К) |
| Стандартная энтропия S | 171,71 Дж/(моль·K) (т) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 119,2 Дж/(моль·K) (т) (при 298 К) |
Как развести марганцовку для прижигания
Темные кристаллы перманганата калия до сих пор присутствуют во многих аптечках, несмотря на то, что продажа этого средства давно прекращена.
Аптека предлагает огромный выбор других самых разных медикаментов на все случаи жизни. Однако, порошок и водный раствор марганцовки для обработки ран всё также пригоден для использования.
В каких случаях можно применять марганцовку
Кристаллы перманганата калия или марганцовки (KMnO4) представляют собой калиевую соль марганцевой кислоты. Порошок тёмно бордового, почти чёрного цвета, хорошо растворим в воде, является сильным окислителем. При контакте с живыми клетками кожи в растворе или чистом виде выделяется атомарный кислород, благодаря этому проявляются антисептические свойства препарата.
Показания:
- Порошок, растворенный в воде, используется для промывки инфицированных ран – 0,1%-0,5%;
- Для обработки поверхностей язв, ожогов – 2-5%;
- Для полоскания рта, горла при инфекциях и воспалениях в носо- и ротоглотке: фарингитах, тонзиллитах, синуситах – 0,01-0,1%;
- Марганцовокислый калий нашел свое применение в лечении женских воспалительных болезней, раствор используется для спринцевания или же промывания при кольпитах, вагинитах, уретритах – 0,02-0,1%;
- В терапии слабо малиновым раствором промывают желудок при отравлении алкалоидами, фосфором, синильной кислотой;
- Для обработки поверхности кожи при попадании анилина;
- Жидкость слабой концентрации применяют для промывания слизистой оболочки глаз при укусе ядовитых насекомых.
Марганцовку нельзя использовать при гиперчувствительности к калию и магнию.
При передозировке возникает боль в полости рта, отек слизистой пищевода, глотки, боль в животе, рвота, понос, возможен ожоговый шок. Чтобы лечение препаратом не привело к печальным последствиям, не стало причиной развития осложнений, порошок нужно правильно разводить марганцовку для обработки раны и не допускать превышения дозировки.
Как правильно развести марганцовку для обработки ран
Для растворения кристаллов соли лучше пользоваться теплой водой, так порошок быстрее растворится. Для разведения воду следует прокипятить, затем остудить примерно до 40 О С. На 1 л жидкости нужно взять щепотку марганцовки.
Чтобы правильно приготовить раствор марганцовки для обработки ран вам необходимо знать:
- Нельзя брать вещество голыми руками, при этом можно получить сильный ожог кожи. Для этой цели используют ложку, нож, либо плоскую деревянную палочку;
- Готовый раствор должен быть светлым малинового оттенка. Если в результате получилась более темная концентрация, то для обработки ран раствор марганцовки необходимо разбавить водой до получения нужного оттенка;
- Нерастворенные частицы оседают на дне емкости, нужно немного подождать, чтобы они растворились либо жидкость необходимо процедить через несколько слоев марли или мелкое сито;
- Готовое средство нужно использовать сразу после приготовления, так как оно не подлежит хранению, оставшийся препарат выливают.
В хирургической практике жидкость используется для обработки ран, а также раствором отмачивают присохшие бинты, чтобы сделать перевязку.
Для промывания желудка не обязательно использовать зонд, пациент просто выпивает 0,5-1,5л светло розовой жидкости, после этого рвота вызывается рефлексом при надавливании на корень языка. При отравлениях алкоголем, морфином, лекарственными препаратами, когда рвоту нужно вызвать немедленно, пациентам также дают выпить марганцовку.
Правильное использование раствора
В быту марганцовку используют для снятия болевых ощущений при мозолях, для этого делают ножные ванны. В тазик с водой также добавляют в столовую ложку поваренной соли или пищевой соды. Ноги опускают в таз на 15 минут, через некоторое время мозоли перестают болеть.
Для профилактики опрелостей грудных детей купают в слабом бледно розовом растворе марганцовки.
Гигиенические ванны оказывают и лечебный эффект при долго незаживающей пупочной ранке, при стафилококковых и стрептококковых поражениях кожи.
Более насыщенным раствором можно обработать пупочную рану после купания.
Светло малиновой жидкостью можно вылечить потливость ног, устранить их неприятный запах. Тёплая ванна для ног с морской солью делается ежедневно по 20 минут до устранения неприятных симптомов. После этого ноги хорошо вытирают, особенно между пальцами, посыпают тальком либо используют пасту Теймурова.
При воспалительных поражениях гортани, при болезнях десен используют слабо концентрированный раствор для орошения ротовой полости, больной очаг нужно полоскать 4 раза в день по 5 минут.